Eiwit proteïne
Eiwit (proteïne) is een door levende organismen gevormde scheikundige verbinding die is opgebouwd uit een groot aantal aminozuren. Het aantal verschillende eiwitten is niet met zekerheid bekend; men schat het aantal bij de mens op ten minste tienduizend. Eiwitten vormen het belangrijkste bestanddeel van de levende organismen, ongeveer de helft van het drooggewicht van mens en dier bestaat uit eiwitten. Maar niet alleen kwantitatief, ook kwalitatief behoren de eiwitten tot de belangrijkste componenten van de levende stof: ze vormen een onmisbaar bouwelement van de cellen en weefsels, de kern en de wand van de cellen bestaan voor een groot deel uit eiwitten.
Van nog grotere betekenis is de rol van de eiwitten als enzymen, de stoffen die de scheikundige reacties in het lichaam mogelijk maken. Alle scheikundige reacties te samen maken de levensverrichtingen mogelijk. Er is geen levensvorm of levensverrichting bekend waarbij geen enkel eiwit een centrale rol speelt; enkele voorbeelden: de samentrekking van spieren (waarbij een dertigtal eiwitten een rol spelen), de stofwisselingsprocessen in alle cellen, het transport van voedingsstoffen en afbraak produkten, de werking van lever en nieren, de klieren met inwendige afscheiding en de hersenen.
Bouw.
Eiwitten zijn opgebouwd uit een groot aantal kleine bouwstenen, de aminozuren (zie Aminozuren) die tot lange ketens met vaak vele zijketens aan elkaar ‘geregen’ zijn. Alle in de levende stof voorkomende eiwitten zijn samengesteld uit slechts twintig verschillende aminozuren waarin het koolstofatoom C een centrale plaats inneemt tussen de zgn. amidegroep NH2, de carboxylgroep COOH en de zgn. restgroep R. Slechts de R verschilt voor de verschillende aminozuren. De NH2(amide)-groep kan als de kop en de COOH(carboxyl)-groep als de staart worden beschouwd. De verbindingen tussen de aminozuren in een eiwit komen tot stand op een kop-staartwijze.
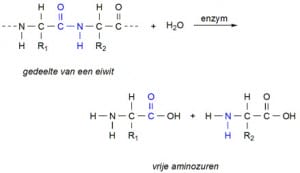
Bij een dergelijke binding tussen twee aminozuren (peptidebinding) blijft een watermolecule (H20) over. De bovenstaande keten van atomen is de ruggegraat van een eiwit en is voor alle eiwitten dezelfde, slechts de zijketens voorgesteld door Ri, R2 enz. zijn verschillend. De samenstelling van een eiwit is van groot belang voor de taak die hij bij een bepaalde levensverrichting heeft. De hoofdkenmerken van een eiwit (structuur van de eerste orde) worden bepaald door het aantal en de volgorde van de aminozuren. Elk aminozuur kan worden voorgesteld door een letter. Door verschillende rangschikking en groepering van de letters ontstaan dan zgn. ‘aminozuur-woorden’. Het is goed voorstelbaar dat op deze wijze met slechts twintig aminozuren een bijzonder groot aantal woorden dus eiwitten gevormd kunnen worden.
Behalve de twee hoofdkenmerken van de eiwit-structuur, aantal en volgorde, die in het platte vlak (tweedimensionaal) kunnen worden voorgesteld, vormen de meeste eiwitten ook nog een ruimtelijke (driedimensionale) opbouw, doordat de lange ketens aminozuren spiralen en allerlei vreemde kronkels gaan vormen. Indien de waterstof atomen tussen de zuurstof atomen van een carboxylgroep en de stikstofatomen van een amidegroep een binding aangaan ontstaat een spiraal. De bindingen van de genoemde waterstofatomen tussen de windingen van de spiraal lopen evenwijdig aan de as van de cilinder die men zich om de spiraal kan denken. Naast hun structuren van de eerste (primaire) en tweede (secundaire) orde hebben vele eiwitten ook een structuur van de derde (tertiaire) orde ten gevolge van bindingen tussen de zijketens van de verschillende aminozuurresten, en het geheel wordt nog ingewikkelder wanneer dit soort spiralen met elkaar grotere samenhangen (conglomeraten) gaat vormen.
De scheikundige spreekt dan van structuren van de vierde (quaternaire) orde. Dat deze ingewikkelde bouw ook van grote betekenis is voor de levensverrichtingen blijkt uit een eenvoudige proef waarbij eiwitten behandeld worden met een zuur of base, waardoor de waterstofbindingen e.d. worden verbroken en de ketens zich ontvouwen. De biologische activiteit gaat daarbij verloren, terwijl er toch verder aan het eiwit niets veranderd is, want de aminozuursamenstelling is dezelfde gebleven en ook de volgorde van de aminozuren is niet veranderd; de driedimensionale bouw is overgegaan in een tweedimensionale.
Onderzoek
De opheldering van de volgorde van de aminozuren van de doorgaans zeer lange eiwitketens is een zeer tijdrovende taak die nog slechts voor een gering aantal eiwitten is uitgevoerd. Van enkele belangrijke eiwitten zoals insuline en de rode bloedkleurstof is de bouw thans opgelost. Bij een dergelijk onderzoek moet allereerst het desbetreffende eiwit in zuivere toestand worden verkregen uit het ingewikkelde eiwitmengsel van een bepaald weefsel. Hierbij wordt gebruik gemaakt van de verschillen die de eiwitten vertonen in oplosbaarheid, elektrische eigenschappen en molecuulgrootte. Vervolgens worden het molecuulgewicht en de aminozuursamenstelling bepaald. Dit laatste geschiedt door de eiwitten in een sterk zuur volledig te splitsen in vrije aminozuren. Vervolgens worden deze gescheiden en hun hoeveelheden bepaald. Men weet in dit stadium van het onderzoek echter nog niets over de volgorde van de aminozuren, hetgeen de eiwitten uiteindelijk verschillend van elkaar maakt.
Men weet nu bijvoorbeeld dat het eiwit bestaat uit 50 aminozuren A, 25 B. 45 C enz. Met de verkregen gegevens kan de bepaling van de volgorde de aminozuur ‘woorden’ beginnen. Daarbij gaat men echter weer uit van het oorspronkelijke eiwit. Dit wordt met behulp van een eiwitsplitsend enzym in een aantal brokstukken gesplitst, die elk bestaan uit een groep aminozuren. Deze brokstukken peptiden worden van elkaar gescheiden en men werkt nu verder met deze brokstukken.
De nu volgende onderzoekmethoden steunen voornamelijk op de analyse van de zgn. eindstandige aminozuren en wel van het aminozuur dat de amidegroep (NH.) de kop van de peptidebinding bevat. De ruggegraat van de eiwitten ontstond door de verbinding tussen de NH2-groep van het ene en de COOH-groep van een volgend aminozuur. Wordt de verbinding hiertussen verbroken dan ontstaat weereen NH: en een COOH-groep. I11 deze fase van het onderzoek bepaalt men het aminozuur waar het vrije NH, deel van uitmaakt, vervolgens wordt er weer een aminozuur afgesplitst enz. Na opheldering van de aminozuurvolgorde in alle bovengenoemde (peptide) brokstukken moeten deze zelf nog in de juiste volgorde worden geplaatst. Derhalve wordt het eiwit met een ander soort enzym volgens een ander specifiek patroon gesplitst en na onderzoek van de dan verkregen brokstukkenzalmen in staatzijn uit te maken welke de totale aminozuurvolgorde van het eiwit moet zijn.
Op deze wijze heeft men de structuur van de eerste orde kunnen vaststellen. De eiwitketens zijn allerminst een lange dunne staaf, integendeel : ze zijn opgevouwen tot ingewikkelde, ruimtelijke bouwsels. Deze ruimtelijke ordening (structuur van de tweede, derde en vierde orde) is niet willekeurig, alle moleculen van een bepaald eiwit zijn op unieke wijze opgevouwen. De vaststelling van de driedimensionale structuur geschiedt met zeer gespecialiseerde methoden, waarbij gebruik wordt gemaakt van moderne röntgenapparatuur, waarmee de kristalstructuur van de eiwitten als het ware kan worden doorgelicht.

Uit het moderne eiwitonderzoek is gebleken dat de meeste eiwitten met een molecuulgewicht groter dan 50000 zijn samengesteld uit een aantal spiraalvormige eenheden, die sub-eenheden worden genoemd. De opbouw van een eiwit uit verschillende sub-eenheden is specifiek, dwz. het aantal en de aard van de sub-eenheden in een bepaald eiwit liggen vast.







Nog geen reacties geplaatst, wees de eerste.